
Эстрогены и их метаболиты в клинической практике
Список сокращений:
E1 — эстрон
E2 — эстрадиол
E3 — эстриол
2-ОН — 2-гидроксиэстрон
4-ОН — 4-гидроксиэстрон
16-ОН — 16α-гидроксиэстрон
COMT — фермент катехол-О-метилтрансфераза
2-MeО — 2-метоксиэстрон
4-MeО — 4-метоксиэстрон
I3C — индол-3-карбинол
DIM — дииндолилметан
ПМС — предменструальный синдром
Эстрогены: роль и выработка
Эстрогены — это стероидные гормоны, которые играют важную роль в регуляции репродуктивной системы, костного обмена, сердечно-сосудистой системы и когнитивных функций. Основные виды эстрогенов включают эстрадиол (E2), эстриол (E3) и эстрон (E1), которые синтезируются в основном в яичниках у женщин и в меньшей степени — в жировой ткани у мужчин и женщин.
Уровень эстрогенов значительно варьируется в зависимости от пола и возраста:
У женщин: эстрадиол достигает пика в середине менструального цикла, а его уровень в фолликулярной фазе обычно составляет 30–120 пг/мл, в лютеиновой фазе — 70–250 пг/мл.
У мужчин: уровень эстрадиола стабильный, 10–50 пг/мл, с минимальным влиянием на репродуктивные функции.
Эстрогены выполняют множество функций:
Репродуктивная система: регуляция менструального цикла, созревание яйцеклетки.
Костный метаболизм: снижение резорбции костной ткани.
Сердечно-сосудистая система: поддержание сосудистой эластичности, снижение уровня ЛПНП.
Когнитивная функция и настроение: предотвращение нейродегенерации, снижение тревожности и депрессии.
Биосинтез
Эстрогены синтезируются из холестерина через промежуточные этапы:
Холестерин → Прегненолон → Прогестерон.
Затем прогестерон преобразуется в андрогены (например, тестостерон).
Тестостерон через действие фермента ароматазы превращается в эстрадиол (E2).
Основные источники синтеза:
У женщин: яичники (во время репродуктивного возраста) и плацента (во время беременности).
У мужчин и женщин: жировая ткань, надпочечники и периферическая ароматизация андрогенов.
Метаболизм эстрогенов происходит в печени в два этапа:
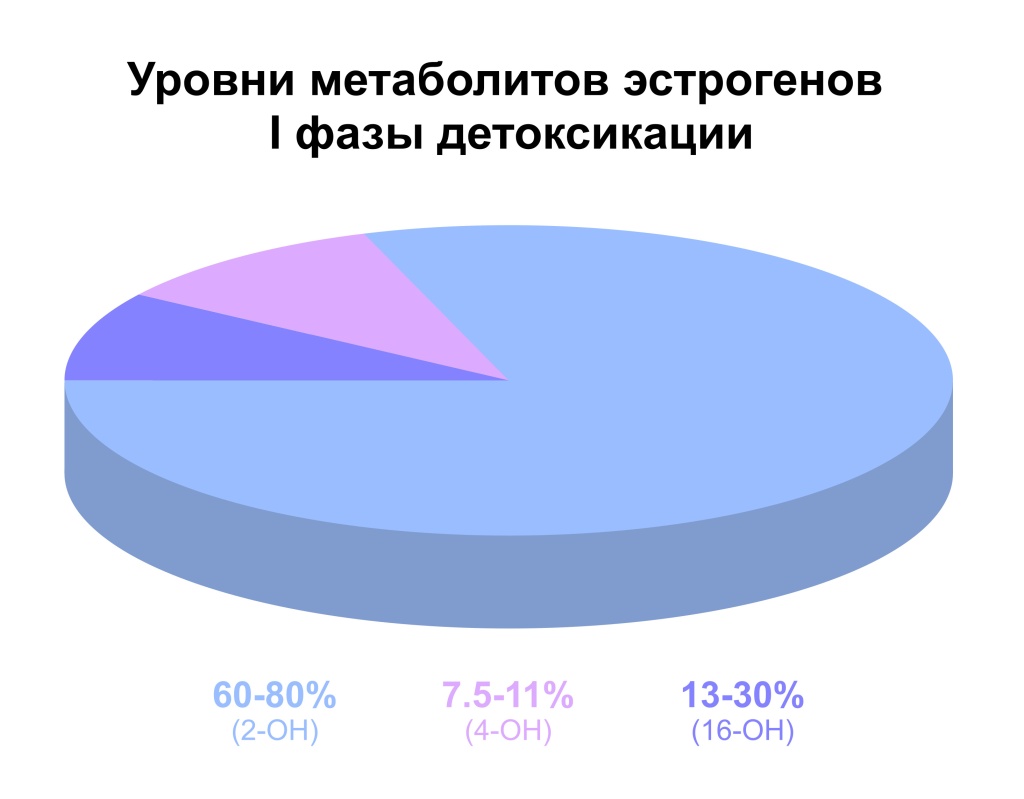
Фаза I: гидроксилирование.
Образуются три ключевых метаболита:
2-гидроксиэстрон (2-ОН), "безопасный" метаболит с низкой эстрогенной активностью.
4-гидроксиэстрон (4-ОН), связанный с риском повреждения ДНК и канцерогенезом.
16α-гидроксиэстрон (16-ОН), обладающий эстрогенной активностью и стимулирующий пролиферацию тканей.
Фаза II: метилирование.
С помощью фермента катехол-О-метилтрансферазы (COMT) 2-ОН и 4-ОН метаболиты превращаются в менее активные соединения:
2-метоксиэстрон (2-MeО)
4-метоксиэстрон (4-MeО)
Метилирование снижает канцерогенные свойства и способствует выведению метаболитов.
Преимущества анализа
Оценка трех типов метаболитов (2-ОН, 4-ОН, 16-ОН) позволяет глубже понять патогенез заболеваний.
Быстрый и малоинвазивный метод диагностики.
Индивидуальный подход к лечению, включая использование препаратов для коррекции метаболизма (например, дииндолилметан, антиоксиданты).
Соотношение 2-ОН/16-ОН
Соотношение 2-ОН/16-ОН — это показатель метаболизма эстрогенов, отражающий баланс между "защитными" и "пролиферативными" метаболитами. Оно активно исследуется в контексте профилактики и диагностики гормонозависимых заболеваний, таких как рак молочной железы, эндометрия, яичников, а также для оценки рисков воспалительных и репродуктивных нарушений.
Что обозначает соотношение 2-ОН/16-ОН?
2-ОН-эстрон (2-гидроксиэстрон):
Метаболит с низкой эстрогенной активностью, который оказывает защитное действие, подавляет клеточную пролиферацию и способствует снижению канцерогенного потенциала.
16-ОН-эстрон (16α-гидроксиэстрон):
Биологически активный метаболит, стимулирующий клеточный рост и пролиферацию. Повышенный уровень связан с воспалением, гиперплазией тканей и канцерогенезом.
Соотношение 2-ОН/16-ОН показывает, какой из путей метаболизма эстрогенов доминирует.
Высокое соотношение (≥2): ассоциируется с меньшим риском гормонозависимых опухолей1.
Низкое соотношение (<1,5): указывает на избыток пролиферативной активности, что связано с риском развития рака, эндометриоза, миомы и других патологий.
Клиническое значение
1. Онкология
Низкое соотношение 2/16 связано с повышенным риском рака молочной2 железы. Исследования показали, что женщины с раком молочной железы часто имеют низкое соотношение (ниже 1,5), что связано с повышенной стимуляцией клеточного роста 16-ОН.
Высокое 2/16 (≥2) ассоциируется с меньшей вероятностью онкогенеза за счет увеличения "безопасных" 2-ОН метаболитов.
2. Репродуктивные нарушения
Миома матки и эндометриоз: низкое соотношение способствует гиперпластическим процессам в эндометрии и миометрии.
Бесплодие: избыток 16-ОН нарушает нормальное созревание эндометрия3, снижая вероятность имплантации эмбриона.
3. Воспалительные и аутоиммунные процессы
16-ОН обладает прооксидантной активностью, увеличивая воспаление и повреждение тканей, что может влиять на такие состояния, как мастопатия или артриты.
Факторы, влияющие на соотношение
Снижают 2/16 (увеличивают 16-ОН):
Ожирение (жировая ткань усиливает ароматизацию андрогенов).
Нарушение функции печени (например, при стеатозе).
Недостаток витаминов группы B и антиоксидантов.
Высокое потребление алкоголя и сахара.
Повышают 2/16 (увеличивают 2-ОН):
Диета с высоким содержанием клетчатки и крестоцветных овощей (брокколи, капуста).
Добавки, такие как индол-3-карбинол (I3C) и дииндолилметан (DIM).
Физическая активность (стимулирует метаболизм эстрогенов).
Использование в клинической практике
1. Диагностика:
Анализ 2/16 используется для прогнозирования риска гормонозависимых опухолей, особенно у женщин с отягощенной наследственностью или наличием фиброзно-кистозной мастопатии.
2. Оценка эффективности терапии:
Показатель отслеживается при назначении гормональной терапии или коррекции метаболизма с помощью добавок.
3. Превентивная стратегия:
Изменение диеты, прием антиоксидантов и корректировка образа жизни могут повысить соотношение 2/16, что снижает риск развития патологий.
Применение анализа метаболитов в клинической практике
Исследование метаболитов эстрогенов позволяет:
1. Диагностировать и прогнозировать заболевания.
Высокие уровни 4-ОН ассоциированы с риском рака молочной железы. Низкое соотношение 2-ОН/16-ОН указывает на повышенный риск опухолей молочной железы и яичников.
2. Оценивать функцию печени.
Плохое метилирование4 свидетельствует о нарушении детоксикации и антиоксидантной активности.
3. Подбирать терапию.
Данные анализа помогают выбрать подходящую тактику нормализации гормонального фона и метаболизма.
Клиническое значение метаболитов:
2-ОН: снижает риск рака молочной железы.
4-ОН: участвует в образовании ДНК-мутаций, связанных с онкогенезом.
16-ОН: повышенный уровень связан с риском рака и гиперплазии эндометрия.
Основные патологии, связанные с нарушением метаболизма эстрогенов
Онкология
Молочная железа: сниженное соотношение 2-ОН/16-ОН связано с повышенным риском рака молочной железы. Увеличение 2-ОН снижает этот риск.
Эндометрий: повышенный 16-ОН может указывать на гиперплазию и предраковые состояния.
Печень: оценка детоксикации.
Анализ уровня метаболитов помогает оценить способность печени к детоксикации и метилированию. Печень отвечает за преобразование эстрогенов и их выведение.
Нарушение фазы II (метилирование): приводит к накоплению активных метаболитов, таких как 4-ОН, повышая риск воспаления, оксидативного стресса и канцерогенеза.
Эстроген и его метаболиты5 выводятся через желчь в кишечник. Однако повышенная активность β-глюкуронидазы (фермента, разрушающего конъюгированные метаболиты) может привести к реабсорбции эстрогенов. Это состояние часто связано с дисбиозом кишечника, который можно корректировать с помощью пробиотиков и клетчатки.
Гинекология
Эндометриоз, миома, нерегулярные циклы: нарушения метаболизма эстрогенов могут усугублять симптомы этих состояний.
Мастопатия: высокий уровень 4-ОН коррелирует с кистозно-фиброзными изменениями молочной железы.
Проблемы с фертильностью
Невынашивание6 беременности часто связано с доминированием 4-ОН и недостаточным 2-ОН.
Коррекция метаболизма эстрогенов может улучшить показатели фертильности.
Кожные заболевания
Повышенный эстроген стимулирует продукцию кожного сала.
Дисбаланс 2-ОН/16-ОН увеличивает воспаление и гиперандрогенные состояния, усиливая проявления акне и себореи.
Психоэмоциональные расстройства
Эстрогены модулируют серотониновую активность, влияя на тревогу, депрессию и симптомы ПМС. Дефицит 2-ОН или низкий уровень эстрадиола.
Щитовидная железа
Повышение эстрогенов (особенно 16-ОН) усиливает связывание тироксина (Т4) с белками, снижая активность свободного Т4 и вызывая симптомы гипотиреоза.
Нарушения соотношения метаболитов эстрогена
2-ОН: Обладает антиэстрогенной активностью, препятствует избыточной пролиферации клеток.
Снижение: увеличивает риск гормонозависимых опухолей, таких как рак молочной железы и яичников, из-за недостаточного подавления клеточного роста.
16-ОН: Активный метаболит, усиливающий пролиферацию тканей.
Повышение: стимулирует рост тканей эндометрия и молочной железы, что связано с развитием миомы, эндометриоза, гиперплазии эндометрия и мастопатии.
4-ОН: Канцерогенный метаболит, может вызывать повреждение ДНК и запускать онкогенез.
Повышение: ассоциировано с повышенным риском рака молочной железы и эндометрия.
Факторы, влияющие на метаболизм
Диета: крестоцветные овощи (например, брокколи) стимулируют 2-гидроксилирование.
Генетика: полиморфизм фермента COMT влияет на скорость метилирования.
Лекарства: индукция ферментов CYP450 (например, флуконазол) замедляет метаболизм.
Лечение и коррекция
Диетические изменения:
Включение крестоцветных овощей (содержащих индол-3-карбинол).
Увеличение потребления антиоксидантов (витамины C, E).
Добавки и препараты:
Дииндолилметан (DIM): стимулирует образование 2-ОН.
Витамины группы B: поддерживают метилирование.
Кальций D-глюкорат: улучшает выведение метаболитов.
Лекарственная терапия:
Ингибиторы ароматазы (например, анастрозол) снижают синтез эстрогенов.
Заключение
Метаболизм эстрогенов играет ключевую роль в поддержании репродуктивного здоровья, профилактике онкологических заболеваний и регуляции других физиологических процессов. Анализ соотношения метаболитов эстрогенов, таких как 2-ОН, 4-ОН и 16-ОН, является важным инструментом диагностики и прогнозирования патологий, включая гормонозависимые опухоли, воспалительные процессы, нарушения репродукции и психоэмоциональные расстройства.
Индивидуальная оценка метаболизма эстрогенов позволяет разработать персонализированные стратегии профилактики и лечения, включающие модификацию диеты, использование нутрицевтиков (I3C, DIM, антиоксидантов) и фармакологическую терапию. Это особенно актуально для пациентов с риском развития рака, эндометриоза, миомы или нарушений детоксикационной функции печени.
Современные данные о роли метаболитов эстрогенов в патогенезе заболеваний подчеркивают необходимость широкого внедрения анализа 2-ОН/16-ОН в клиническую практику для оценки рисков, мониторинга терапии и разработки превентивных мер.
Источники:
1. Modugno F, Kip KE, Cochrane B, Kuller L, Klug TL, Rohan TE, Chlebowski RT, Lasser N, Stefanick ML. Obesity, hormone therapy, estrogen metabolism and risk of postmenopausal breast cancer. Int J Cancer. 2006 Mar 1;118(5):1292-301. doi: 10.1002/ijc.21487. PMID: 16161054.
2. Estrogen metabolite ratio: Is the 2-hydroxyestrone to 16α-hydroxyestrone ratio predictive for breast cancer?
3. Modugno F, Kip KE, Cochrane B, Kuller L, Klug TL, Rohan TE, Chlebowski RT, Lasser N, Stefanick ML. Obesity, hormone therapy, estrogen metabolism and risk of postmenopausal breast cancer. Int J Cancer. 2006 Mar 1;118(5):1292-301. doi: 10.1002/ijc.21487. PMID: 16161054.
4, 5. Estrogen metabolism MET2695v2 041719 © 2019 Metagenics Institute, Inc.
6. The potential role of the E SRRG pathway in placental dysfunction in Reproduction. Authors: Zhiyong Zou, Karen Forbes, Lynda K Harris and Alexander E P Heazell
Запись на эту дату уже закрыта, пожалуйста выберите другую.