
Кортизол: гормон стресса и адаптации
Физиология и регуляция
Кортизол — главный глюкокортикоидный гормон человека, синтезируемый из холестерола в коре надпочечников. Его выработка регулируется по принципу сложной цепи, объединяющей гипоталамус, гипофиз и надпочечники — так называемой оси HPA (Hypothalamic–Pituitary–Adrenal).
В ответ на стресс гипоталамус выделяет кортикотропин-рилизинг-гормон (CRH), который стимулирует переднюю долю гипофиза к секреции адренокортикотропного гормона (АКТГ). АКТГ, в свою очередь, активирует кору надпочечников, усиливая выработку кортизола. Повышение уровня кортизола включает механизм обратной связи — он свободно проходит через гематоэнцефалический барьер и связывается с двумя типами рецепторов с минералокортикоидными рецепторами (MR), которые поддерживают базовый уровень торможения HPA-оси и глюкокортикоидными рецепторами (GR), замедляя транскрипцию генов CRH, AVP и POMC (предшественника АКТГ). Это снижает дальнейший выброс АКТГ и CRH.
Локально активность кортизола регулируется ферментами 11β-гидроксистероиддегидрогеназой (11β-HSD): 11β-HSD1 восстанавливает неактивный кортизон в активный кортизол. 11β-HSD2 инактивирует кортизол в кортизон, защищая ткани от избытка гормона. Таким образом, мозг способен локально регулировать уровень активного кортизола, независимо от его концентрации в системном кровотоке.
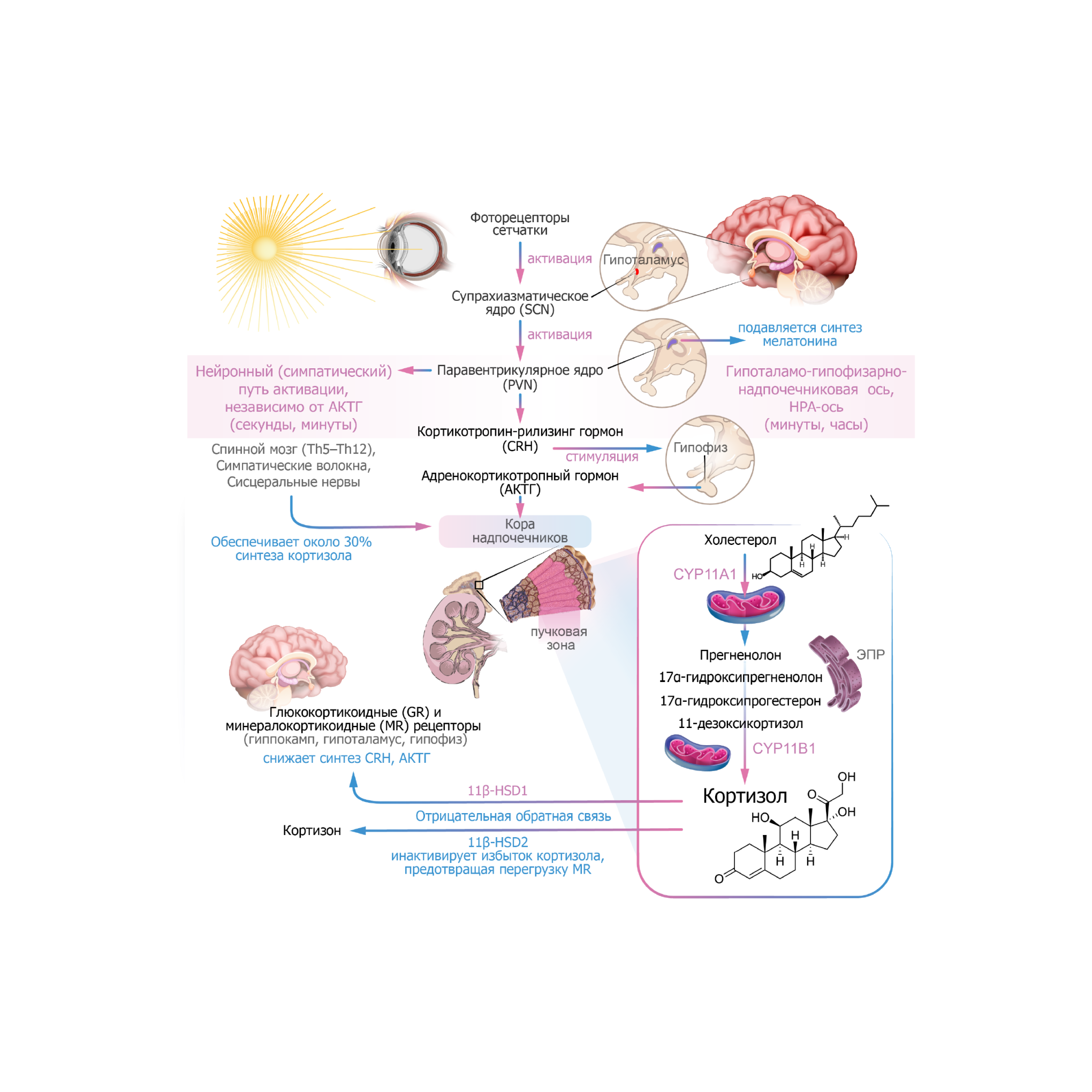
Это динамическая, тонко настроенная система, где важно правильное функционирование каждой её части. На активность оси HPA влияют миндалина, гиппокамп и префронтальная кора — центры, отвечающие за эмоциональную реакцию на стресс.
Современные исследования уточняют, что активность HPA-оси не изолирована. Система тесно связана с регуляцией других гормонов — вазопрессина, мелатонина, гонадолиберина и дегидроэпиандростерона (ДГЭА).
ДГЭА действует как функциональный антагонист кортизола и как биомаркер её функционального состояния, он смягчает действие кортизола на мозг и иммунную систему. Он способствует восстановлению, регенерации и адаптационной перестройке после стрессовой реакции, регулируя действие кортизола через андрогенные и NMDA-зависимые механизмы.
В норме кортизол и ДГЭА работают синхронно, как две стороны одной регуляторной системы. Нарушение нормального ритма секреции ДГЭА отражает функциональное состояние надпочечников и их способность сохранять анаболическую активность при хроническом стрессе. Оба гормона секретируются в соответствии с циркадными ритмами, контролируемыми супрахиазматическим ядром гипоталамуса, что обеспечивает согласованность эндокринных и метаболических процессов адаптации.
Изменения профиля кортизола и ДГЭА показывают, как именно работает стрессовая система — и на какой стадии она сейчас находится.
Математическое моделирование этих взаимодействий показывает, что сдвиг фаз циркадных колебаний, изменение чувствительности рецепторов к глюкокортикоидам и участие вазопрессина (AVP) способны приводить к дезрегуляции HPA-оси и патологическим паттернам секреции кортизола.
Биологические эффекты кортизола
Кортизол действует практически на все ткани организма — его рецепторы обнаружены почти в каждой клетке. Этот гормон помогает организму выживать в стрессовых ситуациях, но при хронической гиперсекреции становится фактором риска для множества патологий.
Основные функции кортизола включают:
Метаболическую регуляцию: в печени он усиливает глюконеогенез — синтез глюкозы из аминокислот, лактата и глицерина, одновременно подавляя синтез гликогена. В мышцах стимулирует распад белков, обеспечивая поступление аминокислот для глюконеогенеза. В жировой ткани активирует липолиз — расщепление триглицеридов на свободные жирные кислоты и глицерин. В поджелудочной железе кортизол снижает секрецию инсулина и усиливает действие глюкагона, поддерживая гипергликемию.
Продолжительная гиперактивация HPA-оси приводит к резистентности тканей к глюкокортикоидам — клетки перестают адекватно реагировать на сигнал гормона из-за снижения экспрессии рецепторов NR3C1. Это нарушает иммунный контроль, усиливает провоспалительный фон (IL-6, TNF-α, IL-1β) и ускоряет процессы клеточного старения. Такой сдвиг связан с развитием аутоиммунных заболеваний, включая системную красную волчанку, ревматоидный артрит и рассеянный склероз.
Нарушение обратной связи HPA-оси при длительном стрессе описано как один из ключевых патогенетических факторов этих состояний
Влияние на сердечно-сосудистую систему: повышение артериального давления и чувствительности сосудов к катехоламинам.
Иммуномодулирующее действие: подавление воспаления и иммунного ответа за счёт уменьшения активности лимфоцитов, макрофагов и синтеза иммуноглобулинов.
Воздействие на нервную систему: улучшение кратковременной концентрации и памяти в острый стресс, но при хроническом повышении уровня — истощение нейронных резервов и когнитивные нарушения.
Эффекты на репродуктивную систему: при длительном стрессе кортизол может снижать выработку гонадотропинов, что приводит к нарушениям менструального цикла и снижению фертильности.
Циркадный ритм и кортизоловый ответ на пробуждение (CAR)
Секреция кортизола регулируется чёткими суточными (циркадными) ритмами. Утром, сразу после пробуждения, уровень гормона резко возрастает и достигает пика примерно через 30–45 минут — это явление называется кортизоловым ответом на пробуждение (Cortisol Awakening Response, CAR).
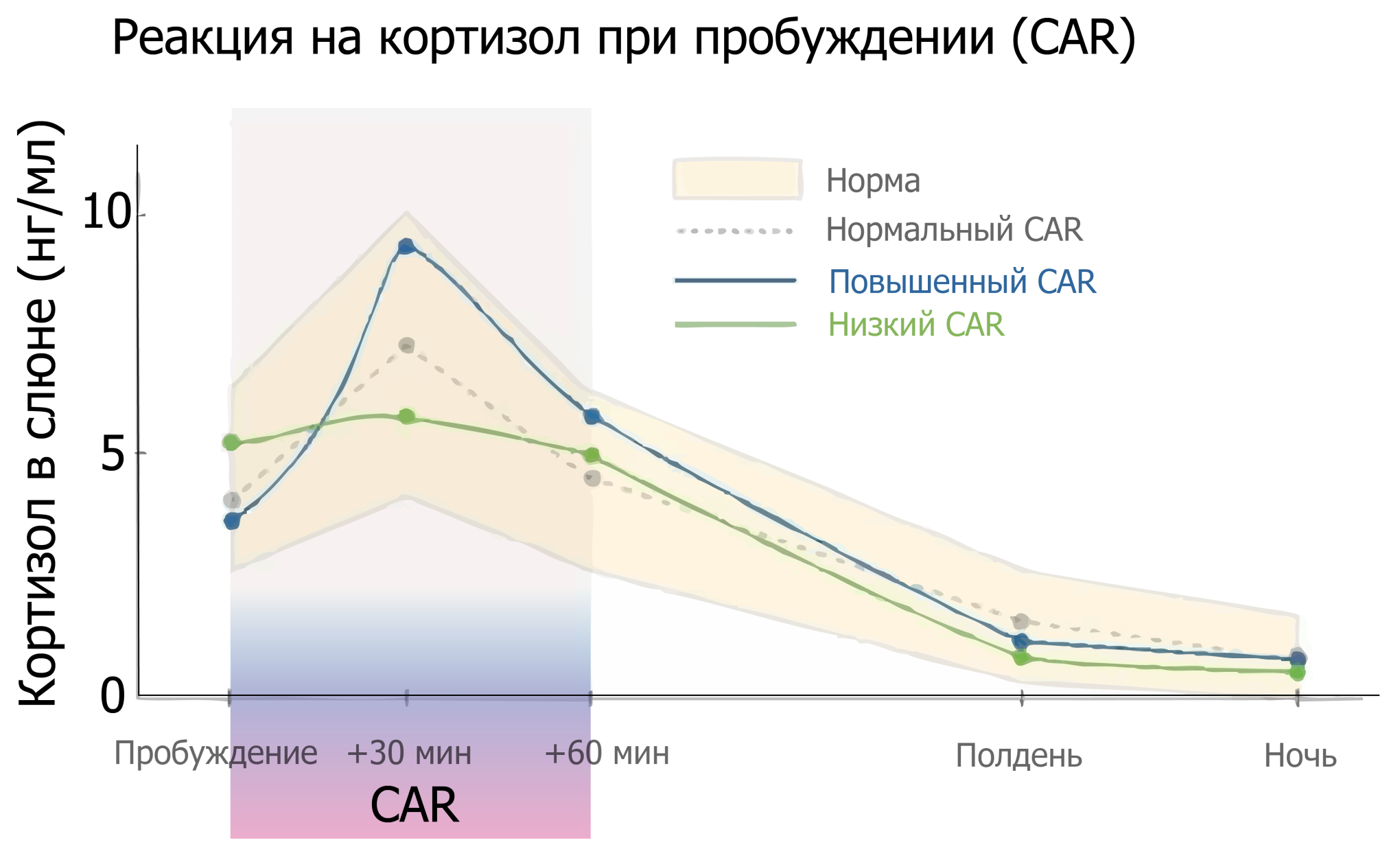
CAR — это не просто часть суточного колебания кортизола, а отдельный физиологический механизм, отражающий способность гипоталамо-гипофизарно-надпочечниковой оси (HPA-оси) быстро активироваться в ответ на переход организма из состояния сна в бодрствование. Генерация этого пика начинается под влиянием света, поступающего на сетчатку глаз, и контролируется супрахиазматическим ядром гипоталамуса — главным «биологическим часами» организма.
Нормальный CAR — признак здоровой адаптационной системы. Он помогает телу активироваться по утрам: мобилизует энергию, активирует внимание, поддерживает артериальное давление и уровень глюкозы. Чем выше амплитуда CAR, тем выше резервы и стрессоустойчивость HPA-оси.
При хроническом стрессе, бессоннице, сменной работе, нарушениях циркадных ритмов и психоэмоциональных перегрузках CAR может быть нарушен. Например, у пациентов с тревожными и депрессивными расстройствами он нередко оказывается повышенным, тогда как при фазе истощения — снижается или вовсе исчезает. Эти отклонения говорят о дезрегуляции нейроэндокринной системы, нарушении обратной связи и утрате нормального суточного ритма.
На практике используют два подхода к оценке циркадной секреции кортизола:
Анализ слюны на кортизол и ДГЭА по 6 точкам.
Это расширенный тест, включающий три утренние точки (0, 30, 60 минут после пробуждения) и три дневные/вечерние. Он позволяет точно оценить динамику CAR, увидеть пиковую реакцию, её продолжительность и эффективность торможения. Такой профиль незаменим при подозрении на ранние стадии стрессовых нарушений, дисфункцию HPA-оси, истощение адаптационных резервов, а также при депрессии, бессоннице, аутоиммунных заболеваниях и метаболических расстройствах.
Анализ слюны на кортизол и ДГЭА по 4 точкам.
Более компактный, но клинически полезный формат. Проводится в течение дня и позволяет оценить общий суточный ритм кортизола: утро, полдень, день и вечер. Он не отражает структуру CAR, но показывает, как HPA-ось справляется с нагрузками в течение суток. Применим при хронической усталости, инсулинорезистентности, ожирении, нарушениях сна, для оценки эффективности гормональной терапии, адаптогенов и антидепрессантов.
Для получения подробного профиля адаптации — рекомендуется шеститочечный тест.
Для мониторинга и первичной оценки четырёхточечный формат остаётся доступным и информативным вариантом.
Клиническое значение CAR невозможно переоценить:
Повышенный CAR может указывать на гиперреактивность HPA-оси — часто наблюдается при начальной фазе стресса, тревожных расстройствах, метаболической нестабильности.
Сниженный CAR свидетельствует об истощении системы, характерен для депрессии, синдрома выгорания, хронической усталости.
Сглаженный вечерний спад кортизола — ещё один маркер хронической дезрегуляции, связанный с нарушениями сна, иммунного ответа и повышением провоспалительных цитокинов, таких как IL-6.
Анализ CAR и суточного ритма кортизола — важный инструмент диагностики функционального состояния HPA-оси. Он позволяет не только подтвердить наличие стресс-дисфункции, но и определить её фазу, выраженность и направление. Это особенно важно при комплексном подходе к лечению психоэндокринных, метаболических и воспалительных заболеваний.
Методы определения кортизола
В современной лабораторной практике для оценки уровня кортизола применяются разные биологические среды: кровь, слюна и моча.
Слюна отражает уровень свободного, биологически активного кортизола, не связанного с белками. Анализ свободного кортизола в вечерней слюне информативен при подозрении на субклинический гиперкортицизм Это неинвазивный, надёжный метод, позволяющий оценивать динамику секреции, включая циркадные колебания и CAR.
Кровь используется для диагностики надпочечниковой недостаточности, синдрома Кушинга и контроля заместительной терапии. Важно учитывать время забора: утренние и вечерние уровни различаются в 3–5 раз.
Моча (суточная экскреция свободного кортизола) позволяет оценить интегральный уровень секреции за сутки и применяется при подозрении на гиперкортицизм.
Наиболее точным методом измерения считается высокоэффективная жидкостная хроматография с масс-спектрометрией (ХМС/МС) — «золотой стандарт» в эндокринологии. В отличие от иммуноферментных анализов, ХМС/МС позволяет достоверно различать схожие по структуре стероиды и измерять их в низких концентрациях.
Кортизол, стресс и ось «кишечник-мозг»
В последние годы активно изучается взаимодействие HPA-оси с осью «кишечник–мозг» (gut-brain axis). Нормальный кишечный микробиом — это активный эндокринно-иммунный орган. Он взаимодействует с HPA-осью по трём основным направлениям:
Нейроэндокринный путь
Некоторые кишечные бактерии (особенно Bifidobacterium, Lactobacillus, Faecalibacterium) синтезируют или модулируют нейромедиаторы: серотонин, ГАМК, дофамин, короткоцепочечные жирные кислоты (SCFA).
Эти молекулы воздействуют на афферентные волокна блуждающего нерва, передавая сигнал напрямую в ствол мозга и гипоталамус. Когда микробиом в порядке — блуждающий нерв активирует парасимпатическую регуляцию, которая снижает активность HPA-оси и уровень кортизола.
При дисбиозе этот баланс нарушается — вагусная модуляция ослабевает, гипоталамус начинает воспринимать внутренние сигналы как стресс, и секреция КРГ возрастает.
Иммунно-воспалительный путь
Дисбиоз повреждает эпителиальный барьер кишечника, что увеличивает проникновение липополисахаридов (ЛПС) в системный кровоток. Эти молекулы активируют макрофаги и дендритные клетки, повышая уровень интерлейкина-6 (IL-6), TNF-α и IL-1β. Эти цитокины напрямую стимулируют гипоталамус к секреции КРГ и гипофиз к выделению АКТГ — таким образом, воспалительный фон усиливает реактивность HPA-оси.
Одновременно повышенная концентрация кортизола подавляет противовоспалительные звенья, но не устраняет источник воспаления, создавая порочный круг: “воспаление → кортизол → истощение рецепторов”.
Метаболический путь
Короткоцепочечные жирные кислоты (КЦЖК), особенно бутират и пропионат, синтезируемые здоровой микробиотой, участвуют в эпигенетической регуляции генов стресс-ответа. Они усиливают экспрессию рецепторов глюкокортикоидов и чувствительность тканей к кортизолу. При снижении количества КЦЖК например, при антибиотикотерапии или дисбиозе, происходит десенситизация рецепторов, из-за чего кортизол остаётся повышенным, но тканевой ответ становится слабым — та самая "гормональная усталость", наблюдаемая при хроническом стрессе.
Современные данные показывают, что восстановление микробиома может нормализовать активность HPA-оси. У пациентов с депрессией и тревожными расстройствами назначение пробиотиков (Lactobacillus rhamnosus, Bifidobacterium longum) снижало уровень кортизола и улучшало показатели CAR. Эти наблюдения стали основанием для появления термина «психобиотики» — штаммов, способных модулировать стрессовую реакцию через ось «кишечник–мозг–надпочечники».
Механизм их действия включает как снижение воспаления и восстановление целостности кишечного барьера, так и влияние на блуждающий нерв и серотонинергическую активность.
Этот двусторонний механизм — пример того, как стресс способен менять состав микробиоты, а изменённая микробиота, в свою очередь, усиливает стрессовую реакцию.
Кортизол и стрессовая реакция
При воздействии стрессора организм включает две взаимосвязанные, но разноскоростные системы.
Симпатоадреналовая система (СНС) — реагирует первой, в течение секунд.
Гипоталамус активирует симпатические центры ствола мозга, и через преганглионарные волокна стимулирует мозговое вещество надпочечников.
В ответ выделяются катехоламины — адреналин и норадреналин, которые обеспечивают мгновенную реакцию «бей или беги»: тахикардию, вазоконстрикцию, повышение давления, гликогенолиз, приток крови к мышцам.
Гипоталамо-гипофизарно-надпочечниковая ось (HPA) — включается через несколько минут после начала стрессовой реакции.
Гипоталамус выделяет кортикотропин-рилизинг-гормон (CRH), который стимулирует секрецию АКТГ гипофизом.
АКТГ активирует кору надпочечников, и начинается выработка кортизола.
Кортизол обеспечивает продолжительную адаптацию: поддерживает уровень глюкозы, стабилизирует давление, модулирует воспаление, восстанавливает энергетический баланс.
Миндалина — ключевой центр распознавания угрозы и эмоциональной оценки событий — активирует гипоталамус, инициируя каскад стрессовой реакции: выделение КРГ, АКТГ и последующий выброс кортизола надпочечниками, поддерживая уровень глюкозы, артериального давления и энергетическую готовность.
Когда опасность проходит, парасимпатическая система снижает этот ответ, возвращая организм в состояние равновесия.
При хроническом стрессе чувствительность оси HPA к обратной связи снижается: уровень кортизола остаётся повышенным, а циркадный ритм сглаживается — формируется нейроэндокринная основа синдрома хронической усталости и эмоционального выгорания.
Гиперкортицизм (синдром Кушинга) — состояние хронически повышенного уровня кортизола.
Различают:
Экзогенный (ятрогенный) — вследствие длительного приёма глюкокортикоидов (преднизолон, дексаметазон).
Эндогенный — результат избыточной продукции кортизола надпочечниками или повышенной секреции АКТГ при опухолях гипофиза и эктопических источниках.
Основные проявления: центральное ожирение, лунообразное лицо, гипертония, гипергликемия, гирсутизм у женщин, остеопороз и мышечная слабость.
Гипокортицизм (болезнь Аддисона) — противоположное состояние, при котором надпочечники не вырабатывают достаточного количества кортикостероидов.
Первичная форма связана с аутоиммунным поражением коры надпочечников; вторичная — с дефицитом АКТГ при патологии гипофиза.
Симптомы включают хроническую усталость, снижение массы тела, гиперпигментацию, гипотонию и тягу к соли.
Обе формы требуют подтверждения лабораторными тестами (кортизол крови, тест с АКТГ, дексаметазоновая проба) и последующего динамического контроля.
Кортизол — маркер не только физиологического стресса, но и психоэмоционального состояния. Хронический стресс, посменная работа, нарушения сна и депрессия меняют профиль секреции гормона, что отражается на работе иммунной, сердечно-сосудистой и нервной систем.
При остром стрессе кортизол мобилизует ресурсы организма, помогая выстоять. Но при длительном воздействии стрессоров он разрушает собственные адаптационные механизмы, способствуя развитию тревожных и депрессивных расстройств, инсулинорезистентности, гипертензии и нарушений сна.
Физиологический ритм секреции кортизола — с высоким утренним пиком и низким ночным уровнем — необходим для нормального энергетического обмена, концентрации внимания и здорового сна. Его нарушение — сигнал о сбое биологических часов и дисрегуляции HPA-оси.
Анализы, выполняемые в CHROMOLAB:
GS-1.1 Кортизол и ДГЭА в слюне (4 порции): адаптация и стресс
GS-1.2 Кортизол и ДГЭА в слюне (6 порций, CAR): адаптация и стресс
GH17 Кортизол в слюне (одна порция), метод ХМС
GH3.1 Кортизол в слюне, (2 порции), метод ХМС
Запись на эту дату уже закрыта, пожалуйста выберите другую.