
Описание
Кортизол, гормон стресса - глюкокортикоидный гормон, который синтезируется из холестерина в коре надпочечников. Выработка кортизола начинается в гипоталамусе. Кортикотропин-рилизинг-гормон, (КРГ), выделяется из паравентрикулярного ядра гипоталамуса и стимулирует переднюю долю гипофиза к выделению АКТГ - адренокортикотропного гормона. АКТГ - гормон, который стимулирует кору надпочечников выделять глюкокортикоиды, такие как кортизол. Это гипоталамо-гипофизарно-надпочечниковая HPA ось. Ось HPA представляет собой систему отрицательной обратной связи, в которой присутствие кортизола подавляет выработку CRH и АКТГ. [1]
Биологическая роль и функции в организме
Благодаря наличию глюкокортикоидных рецепторов практически в каждой клетке организма, кортизол влияет на многие системы органов: опорно-двигательный аппарат, сердечно-сосудистую систему, органы дыхания, эндокринную систему, нервную систему. Клетки человеческого организма получают и используют этот гормон различными способами. Кортизол повышает артериальное давление, уровень глюкозы в крови, может быть причиной развития бесплодия у женщин и подавляет работу иммунной системы.
Методы количественного определения кортизола
Уровень кортизола в слюне - показатель несвязанного или “свободного”, кортизола, который является биологически значимым и позволяет легко отбирать пробы в клинических и полевых условиях. Забор слюны - надежный, неинвазивный метод определения биологически активного, несвязанного кортизола [1] Кортизол, который синтезируется из холестерина, является основным глюкокортикоидом в пучковой зоне коры надпочечников человека. Его секреция в ответ на стресс способствует подавлению гипоталамо-гипофизарно-надпочечниковой системы, влияющей на состояние здоровья и когнитивные процессы. Поскольку большинство действий кортизола основано на его связывании с цитозольными рецепторами, биологически активной оказывается лишь небольшая часть несвязанного, свободного кортизола. Он выделяется из митохондрий, мигрирует из клетки во внеклеточное пространство и кровоток. Благодаря низкой молекулярной массе и липофильности несвязанный кортизол проникает в клетки путем пассивной диффузии, что позволяет измерять содержание свободного кортизола во многих жидкостях организма.
Как правило, уровень кортизола в крови повышается ранним утром (самый высокий уровень примерно в 8 часов утра) и снижается вечером и во время ранней фазы сна [2]. Поэтому очень важно выбрать время для взятия пробы крови. Определение уровня кортизола в поте или слезах имеет лишь теоретическое значение, в моче представляет меньший интерес, а измерение уровня кортизола в слюне имеет преимущества перед оценкой уровня кортизола в крови [3].
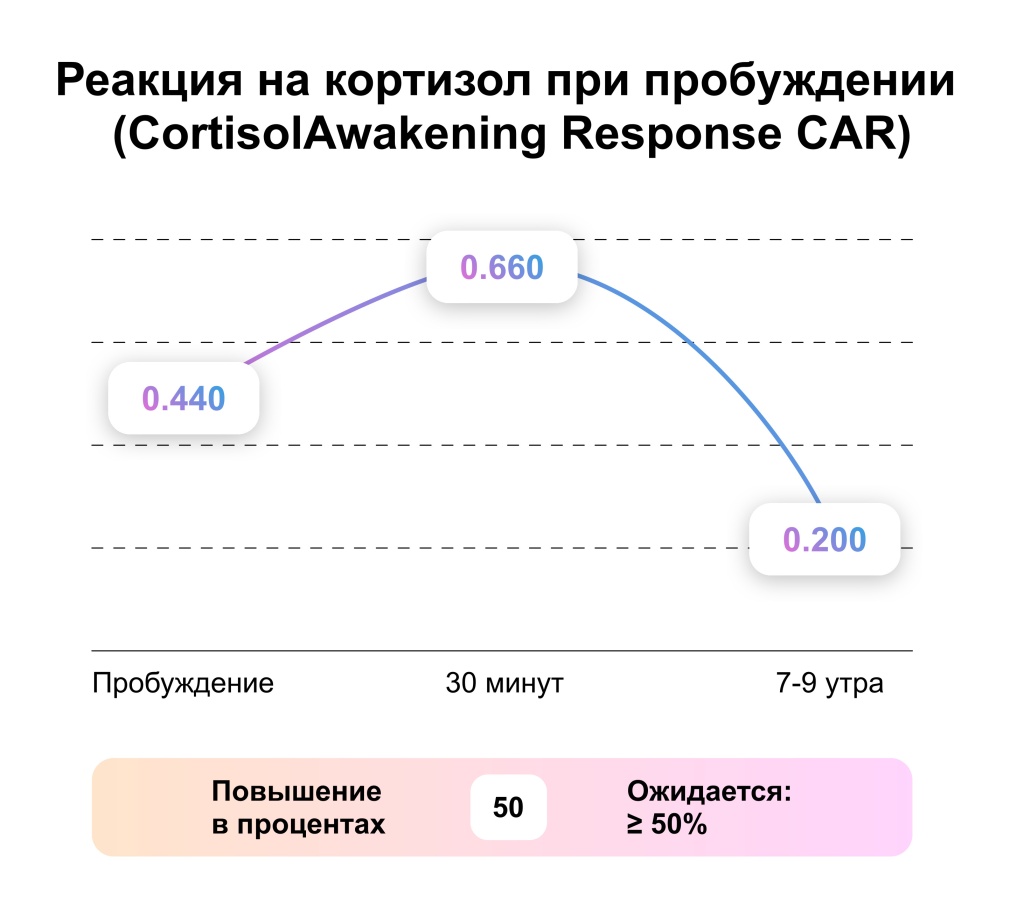
Пробы на кортизол при пробуждении – CAR
Первую пробу слюны собирают сразу после пробуждения, не вставая с постели, далее через 30 минут после пробуждения и следующую в промежутке с семи и девятью утра.
CAR – основная часть – главная фаза циркадного 24-го суточного ритма. В среднем продолжительность CAR 30 минут после момента пробуждения с пиковым значение уровня кортизола. [4]. Появление освещения в темном пространстве влияет на пробуждение. Луч света задействует центр в головном мозге. В настоящее время точно установлено, что воздействие света ранней ночью переводит биологические часы назад, а воздействие света в позднее ночное время переводит биологические часы вперед.
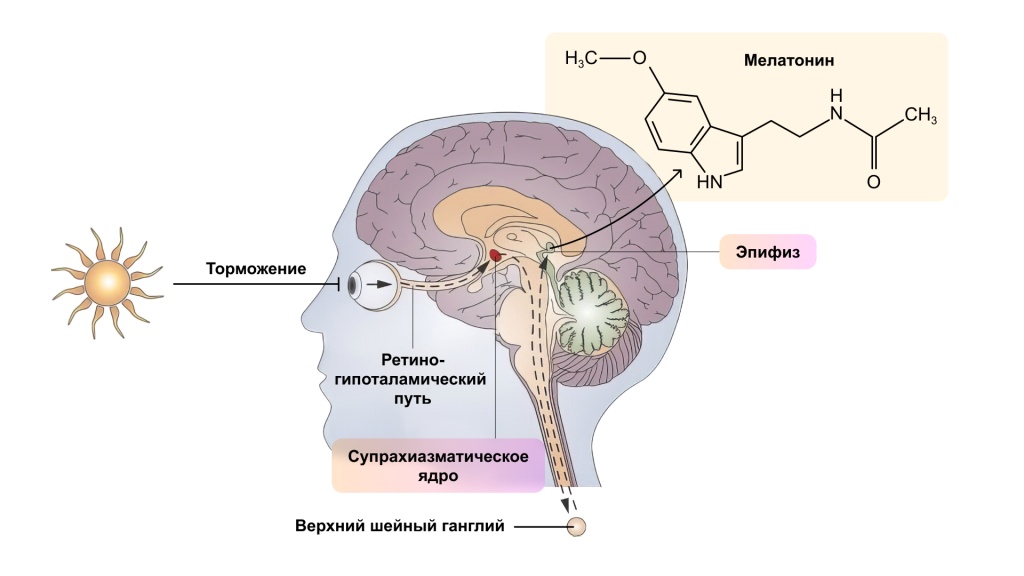
Примечательно, что крошечное супрахиазматическое ядро (SCN), которое парно лежит у основания гипоталамуса и расположено в перекресте зрительных нервов, оказалось необходимым для генерации циркадных ритмов. [5]
В ночное время, когда уровень кортизола низкий, вырабатывается гормон мелатонин. SCN разными путями влияет на CAR: через паравентрикулярное ядро (PVN), через HPA-ось (каскад последовательных активаций кортикотропин-рилизинг-гормона и адренокортикотропного гормона) и прямым действием на кору надпочечников через splanchnic nerve.
CAR - кратковременное, немедленное повышение уровня кортизола при пробуждении, отличается от суточного ритма и отражает способность человека справляться с ожидаемыми трудностями и способность контролировать хронический стресс, что дает представление об устойчивости HPA-оси. Измерение CAR может быть использовано в качестве “мини-стресс-теста”. Исследования показывают, что величина этого увеличения коррелирует с функцией оси HPA, даже если все остальные выборочные измерения находятся в пределах допустимого диапазона.
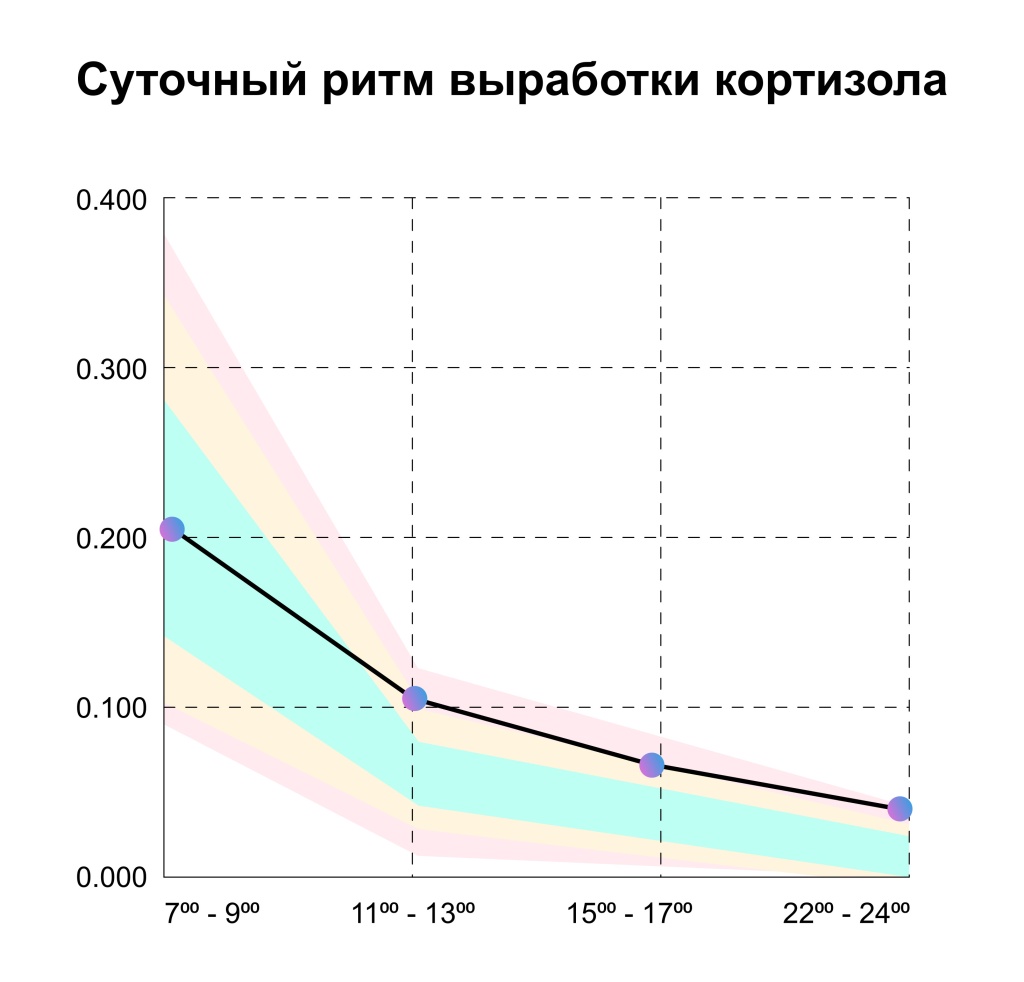
Естественный суточный ритм кортизола достигает пика в течение первого часа после пробуждения, резко снижается в утренние часы, затем постепенно снижается в течение оставшейся части дня, прежде чем достичь ночного минимума.
Повышение уровня кортизола в течение дня может быть вызвано различными физическими, психологическими и эмоциональными причинами, также нарушением регуляции уровня глюкозы, физическими нагрузками и ответом на боль.
С 7:00-9:00 утра уровень кортизона отражает реакцию надпочечников, опосредованную АКТГ.
Повышение уровня кортизола может быть связано с физической нагрузкой, нарушением регуляции уровня глюкозы в крови, стрессом, болевым синдромом или болезнью Кушинга.
Снижение уровня кортизола может быть связано с дисфункцией надпочечников и/ или снижением регуляции из-за хронического стресса.
С 9:00 - 11:00 утра уровень кортизола отражает адаптивную функцию HPA-оси к дневным задачам.
С 15:00 - 17:00 дня уровень кортизола часто отражает гликемический контроль.
С 22:00 - 24:00 вечера уровень кортизола отражает базовую функцию HPA-оси, самый низкий уровень.
Реакция на стресс
Организм человека постоянно реагирует на внутренние и внешние стрессоры, обрабатывает информацию и реагирует соответствующим образом в зависимости от степени угрозы. Вегетативная нервная система организма подразделяется на симпатическую нервную систему (СНС) и парасимпатическую нервную систему (ПНС). Во время стресса СНС активизируется. СНС отвечает за реакцию "Бей или беги", которая вызывает каскад гормональных и физиологических реакций. Миндалевидное тело отвечает за обработку страха, возбуждения и эмоциональных стимулов для определения соответствующей реакции. При необходимости миндалевидное тело посылает сигнал о стрессе в гипоталамус. [6] Гипоталамус активирует СНС, а надпочечники выделяют выброс катехоламинов, таких как адреналин; это вызывает тахикардию, гипертонию, потоотделение, учащение дыхания и повышение уровня глюкозы в крови. Поскольку организм продолжает воспринимать раздражители как угрозу, гипоталамус активирует ось HPA. Кортизол выделяется из коры надпочечников и позволяет организму продолжать оставаться в состоянии повышенной готовности. Когда угроза минует, парасимпатическая нервная система снижает реакцию СНС.
Уровень глюкозы в крови
Уровень глюкозы в крови влияет на ключевые системные и внутриклеточные процессы. Наличие глюкокортикоидов, таких как кортизол, увеличивает поступление глюкозы в мозг. Кортизол воздействует на печень, мышцы, жировую ткань и поджелудочную железу. В печени высокий уровень кортизола усиливает глюконеогенез и снижает синтез гликогена. Глюконеогенез - метаболический процесс, который приводит к образованию глюкозы из глюкогенных аминокислот, лактата или глицерол-3-фосфата, содержащихся в триглицеридах. Глюконеогенез обращает вспять гликолиз, цитоплазматический путь, используемый для преобразования глюкозы в молекулы пирувата. Этот путь используется для высвобождения энергии посредством реакций фосфорилирования и окисления на уровне субстрата. В отличие от гликолиза, глюконеогенез активизируется, когда организму требуется энергия. Мышцы обладают собственным внутренним запасом гликогена, который позволяет им быстро реагировать на изменение потребности в АТФ. В присутствии кортизола мышечные клетки снижают усвоение глюкозы и ее потребление и ускоряют расщепление белка; это обеспечивает глюконеогенез глюкогенными аминокислотами [7]. В жировых тканях кортизол усиливает липолиз. Липолиз - катаболический процесс, который приводит к высвобождению глицерина и свободных жирных кислот. Эти свободные жирные кислоты могут быть использованы для бета-окисления и в качестве источника энергии для других клеток, поскольку они продолжают вырабатывать глюкозу. Наконец, кортизол воздействует на поджелудочную железу, снижая уровень инсулина и повышая уровень глюкагона. Глюкагон - пептидный гормон, секретируемый альфа-клетками поджелудочной железы для усиления гликогенолиза печени, глюконеогенеза печени, кетогенеза печени, липолиза, а также для снижения липогенеза. Кортизол усиливает активность глюкагона, адреналина и других катехоламинов.
Система гипоталамус-гипофиз-надпочечники регулирует выработку кортизола, и при отсутствии контроля перепроизводство и недостаточное производство кортизола вызывают синдром Кушинга и болезнь Аддисона соответственно. Тест на уровень кортизола используется для контроля функции надпочечников и гипофиза. На основании результатов теста на уровень кортизола можно диагностировать болезнь Аддисона и синдром Кушинга. [8] [9]
Гиперкортицизм
Гиперкортицизм, известный как синдром Кушинга, возникает, когда организм человека подвергается воздействию высоких уровней кортизола в течение длительного периода времени. Синдром Кушинга подразделяют на экзогенный (ятрогенный) и эндогенный. [1]
Экзогенный синдром Кушинга возникает в результате приема кортикостероидов перорально или инъекционно. Пероральные кортикостероиды, такие как преднизолон, повышают уровень кортизола в организме. Их обычно назначают для облегчения симптомов, связанных с воспалительными заболеваниями, такими как волчанка и ревматоидный артрит. Стабильно высокий уровень избыточного кортизола вызывает синдром Кушинга.
Эндогенный синдром Кушинга обусловлен перепроизводством кортизола в организме. Крайне редко кора надпочечников вырабатывает избыточный кортизол в отсутствие опухоли. Наиболее распространенной причиной эндогенного синдрома Кушинга является опухоль надпочечников или гипофиза, выделяющая гормоны. Опухоли надпочечников вызывают избыточную выработку кортизола, в то время как опухоли гипофиза вызывают перепроизводство АКТГ. Избыточная выработка АКТГ вызывает выброс слишком большого количества кортизола корой надпочечников. Симптомы синдрома Кушинга зависят от того, насколько высок уровень кортизола. Некоторые общие признаки и симптомы включают увеличение веса в верхней части тела и на лице, жировые отложения между лопатками, диабет, гипертонию, гирсутизм у женщин, слабость и остеопороз. [8]
Гипокортицизм, также известный как болезнь Аддисона, возникает, когда надпочечники не вырабатывают достаточного количества кортикостероидов. Первичная надпочечниковая недостаточность возникает в результате атаки организма на кору надпочечников [10]. Пациенты с первичной надпочечниковой недостаточностью обычно страдают другими аутоиммунными заболеваниями. Вторичная надпочечниковая недостаточность возникает, когда гипофиз не вырабатывает достаточного количества АКТГ, что может быть вызвано опухолями гипофиза и воспалительными процессами. Симптомами болезни Аддисона являются потеря веса, гиперпигментация и усталость. Для лечения симптомов гипокортицизма требуется заместительная стероидная терапия.
Количество кортизола, присутствующего в сыворотке крови, меняется в течение суток: самый высокий уровень наблюдается ранним утром, а более низкий - вечером, через несколько часов после отхода ко сну [11].
Кортизол связывается с цитозольными глюкокортикоидными рецепторами. После связывания с рецептором вновь образованный комплекс рецептор-лиганд перемещается в ядро клетки, где он связывается со многими элементами глюкокортикоидного ответа в промоторной области генов-мишеней. Затем связанный с ДНК рецептор взаимодействует с основными факторами транскрипции, вызывая увеличение экспрессии специфических генов-мишеней [12]. Кортикостероиды подавляют работу иммунной системы из-за снижения функции лимфатической системы, снижения концентрации иммуноглобулинов и комплемента, развития лимфоцитопении и нарушения связывания антиген-антитело.

Различные психологические и физические стрессоры могут активировать ось HPA таким образом, что высвобождаются кортикотропин-рилизинг-гормон (CRH) и адренокортикотропный гормон (АКТГ) с последующим повышением уровня кортизола. Как только активируется ось HPA, требуется примерно 15-30 минут, чтобы уровень кортизола достиг пика. Секреция кортизола имеет циркадный характер, достигая пика ранним утром (примерно через 20-30 минут после пробуждения) и снижаясь около полуночи и короткие всплески секреции кортизола в течение дня. Суточный ритм секреции кортизола устанавливается в раннем детстве. Доказано, что функция и регуляция оси HPA оказывают значительное влияние на рост и развитие. Недостаточная регуляция реакции кортизола на эмоциональный стресс коррелирует с негативным воздействием на когнитивное и эмоциональное состояние [13].
Стресс может привести развитию физиологических и психологических проблем со здоровьем. Иногда стресс может быть полезным, поскольку он дает импульс и энергию, которые помогают людям справляться с такими ситуациями, как экзамены или сжатые сроки на работе.
Однако чрезмерный стресс может привести к негативным последствиям и скажется на работе иммунной, сердечно-сосудистой, нейроэндокринной и центральной нервной системах. В частности, хронический стресс может оказывать серьезное воздействие из-за устойчивого высокого уровня соединений, высвобождаемых в ответ на «борьбу или бегство», что вовлекает эндокринную систему, выделяющую глюкокортикоиды [14]. В нормальном физиологическом состоянии организма уровень кортизола следует четкому циркадному ритму, обычно достигая своего пика ранним утром, чтобы поддержать процесс пробуждения, и постепенно снижаясь в течение дня. Этот циркадный ритм необходим для поддержания энергетического баланса, повышения бдительности и облегчения функций организма, которые соответствуют требованиям повседневной деятельности. Нарушения циркадного ритма секреции кортизола, будь то из-за генетики, возраста или посменной работы, могут привести к нарушению режима сна, расстройствам настроения и нарушению когнитивных функций.
Повышение уровня кортизола может быть вызвано стрессом, терапией экзогенных стероидов и опухолями, секретирующими кортизол или АКТГ. Хронический стресс, приводящий к постоянному повышению уровня кортизола, может способствовать развитию таких состояний, как «усталость надпочечников», подавление иммунной системы и нарушения режима сна.
Недостаточная выработка кортизола, наблюдаемая при таких состояниях, как болезнь Аддисона, может привести к хронической усталости, потере веса, потемнению кожи и тяге к соли. [15] Со временем хронический стресс может привести к гиперактивности надпочечников, что приводит к снижению выработки кортизола. Исследователь Ханс Селье в своей модели реагирования на стресс назвал это стадией истощения - "усталостью надпочечников" или "эмоциональным выгоранием".
Список используемой литературы:
1. Lee D. Y., Kim E., Choi M. H. Technical and clinical aspects of cortisol as a biochemical marker of chronic stress //BMB reports. – 2015. – Т. 48. – №. 4. – С. 209.
2. Weitzman E. D. et al. Twenty-four hour pattern of the episodic secretion of cortisol in normal subjects //The Journal of Clinical Endocrinology & Metabolism. – 1971. – Т. 33. – №. 1. – С. 14-22.
3. Hellhammer D. H., Wüst S., Kudielka B. M. Salivary cortisol as a biomarker in stress research //Psychoneuroendocrinology. – 2009. – Т. 34. – №. 2. – С. 163-171.
4. Fries E., Dettenborn L., Kirschbaum C. The cortisol awakening response (CAR): facts and future directions //International journal of Psychophysiology. – 2009. – Т. 72. – №. 1. – С. 67-73.
5. Gillette M. U., Tischkau S. A. Suprachiasmatic nucleus: the brain's circadian clock //Recent progress in hormone research. – 1999. – Т. 54. – С. 33-58; discussion 58.
6. Gillette M. U., Tischkau S. A. Suprachiasmatic nucleus: the brain's circadian clock //Recent progress in hormone research. – 1999. – Т. 54. – С. 33-58; discussion 58.
7. Kletzien R. F., Weber C. A., Stumpo D. J. Coordinate regulation of gluconeogenesis by the glucocorticoids and glucagon: evidence for acute and chronic regulation by glucagon //Journal of Cellular Physiology. – 1981. – Т. 109. – №. 1. – С. 83-90.
8. Elias P. C. L. et al. Late-night salivary cortisol has a better performance than urinary free cortisol in the diagnosis of Cushing's syndrome //The Journal of Clinical Endocrinology & Metabolism. – 2014. – Т. 99. – №. 6. – С. 2045-2051.
9. Törnhage C. J. Salivary cortisol for assessment of hypothalamic-pituitary-adrenal axis function //Neuroimmunomodulation. – 2009. – Т. 16. – №. 5. – С. 284-289.
10. Neary N., Nieman L. Adrenal insufficiency: etiology, diagnosis and treatment //Current Opinion in Endocrinology, Diabetes and Obesity. – 2010. – Т. 17. – №. 3. – С. 217-223.
11. Ljubijankić N. et al. Daily fluctuation of cortisol in the saliva and serum of healthy persons //Bosnian journal of basic medical sciences. – 2008. – Т. 8. – №. 2. – С. 110.
12. Scheschowitsch K., Leite J. A., Assreuy J. New insights in glucocorticoid receptor signaling—more than just a ligand-binding receptor //Frontiers in endocrinology. – 2017. – Т. 8. – С. 16.
13. Daskalakis N. P., Lehrner A., Yehuda R. Endocrine aspects of post-traumatic stress disorder and implications for diagnosis and treatment //Endocrinology and Metabolism Clinics. – 2013. – Т. 42. – №. 3. – С. 503-513.
14. Bell A., Ross K. The neuro psycho physiological effects of chronic and excessive stress //American International Journal of Social Science. – 2014. – Т. 3. – №. 1. – С. 199-213.
15. De Bellis A. et al. Revisitation of Autoimmune Addison’s Disease: known and Open Pathophysiologic and Clinical Aspects. – 2019.
Запись на эту дату уже закрыта, пожалуйста выберите другую.