
Что может сказать ТМА (триметиламин) и ТМАО (триметиламин оксид) при диагностике атеросклероза и диабета?
Список сокращений:
ТМА – триметиламин
ТМАО – триметиламин-N-оксид, триметиламин окисленный
ССЗ – сердечно-сосудистые заболевания
FMO – флавинсодержащая монооксигеназа
NF-κB – ядерный фактор каппа-В, от англ. nuclear factor kappa-light-chain-enhancer of activated B cells
ECs – эндотелиальные клетки
VSMCs — vascular smooth muscle cells (гладкомышечные клетки сосудов)
РФК — реактивные формы кислорода
Триметиламин (ТМА) и его окисленная форма триметиламин-N-оксид (ТМАО) играют роль в ряде патологий, включая сердечно-сосудистые и метаболические заболевания. В последние годы ТМАО привлекает внимание ученых как потенциальный биомаркер и фактор риска заболеваний, связанных с диетой и микробиотой кишечника.
Биохимическая характеристика ТМА/ТМАО
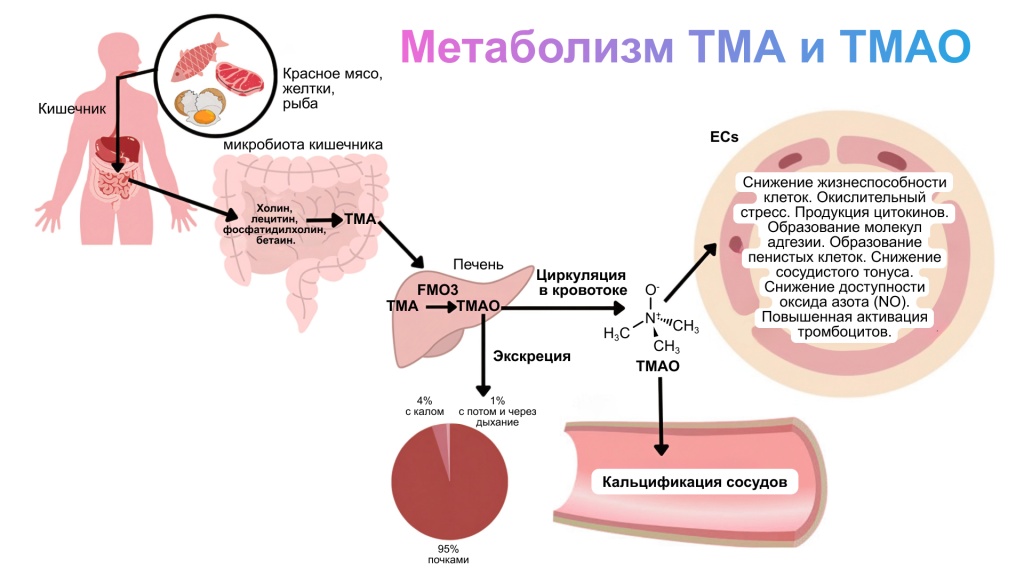
Процесс образования: ТМА синтезируется из пищевых источников под воздействием кишечной микробиоты.
Окисление до ТМАО: Процесс проходит в печени, где ТМА превращается в ТМАО под действием ферментов группы флавинсодержащих монооксигеназ.
Процесс образования ТМА и ТМАО – это многоэтапный процесс, зависящий как от состава микробиоты, так и от активности ферментов печени, что делает его уровень перспективной мишенью для терапии и профилактики различных заболеваний. Метаболизм включает несколько стадий, с участием микробиоты и ферментов печени.
1. Синтез ТМА в кишечнике:
ТМА образуется в кишечнике путем ферментативного разложения некоторых пищевых компонентов, богатых холином, лецитином и L-карнитином, которые содержатся в продуктах животного происхождения (красное мясо, рыба, яйца и молочные продукты). Эти вещества метаболизируются кишечными бактериями, которые превращают их в триметиламин. В частности, на синтез ТМА оказывают влияние бактерии, такие как Clostridia и Desulfovibrio.
2. Окисление ТМА до ТМАО в печени:
После всасывания ТМА поступает в печень, где окисляется до ТМАО с помощью ферментов флавинсодержащей монооксигеназы (FMO), в первую очередь FMO3. Этот фермент катализирует присоединение кислорода к молекуле ТМА, образуя ТМАО. Реакция требует молекулярного кислорода и происходит в эндоплазматическом ретикулуме гепатоцитов.¹
Генетическая изменчивость в FMO3 может влиять на эффективность этого процесса: некоторые мутации в гене FMO3 приводят к замедленному превращению ТМА в ТМАО, что в тяжелых случаях вызывает накопление ТМА и развитие синдрома «рыбного запаха» (триметиламинурии) ².
3. Функция и роль ТМАО:
После образования в печени ТМАО циркулирует в крови, влияя на осморегуляторную функцию и на стабильность клеточных мембран. Однако, при повышенных уровнях ТМАО может стимулировать воспалительные процессы, способствовать образованию пенистых клеток и нарушать функцию эндотелия, что связано с повышенным риском сердечно-сосудистых и метаболических заболеваний.
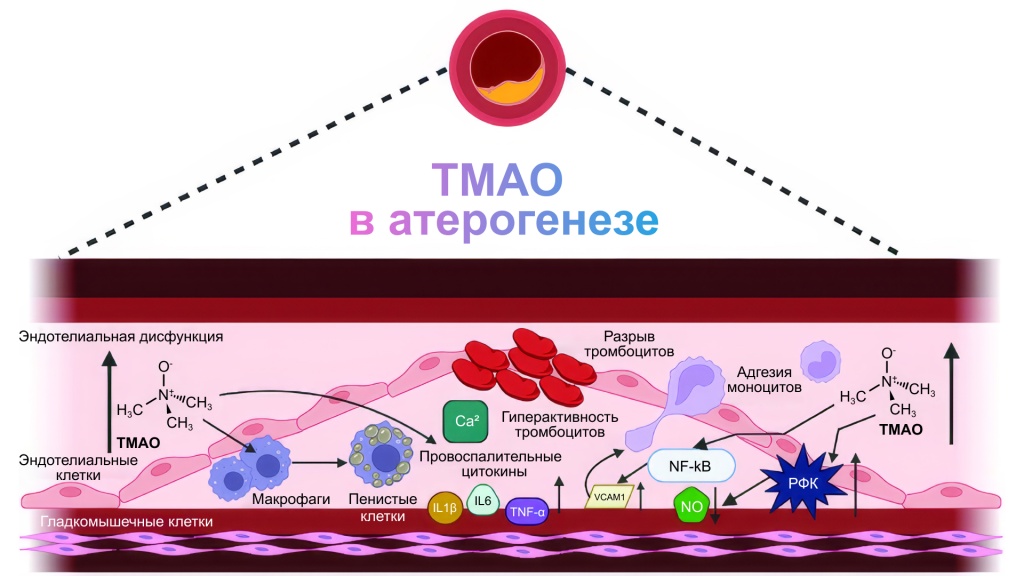
Патогенетическая роль ТМАО
Системное воспаление: ТМАО увеличивает уровень провоспалительных цитокинов, усиливая воспаление в стенках сосудов.
Нарушение регуляции сосудистого тонуса: ТМАО снижает продукцию оксида азота (NO), нарушая сосудорасширение и способствуя гипертензии.
Уровень ТМАО коррелирует с риском ССЗ, диабета, что связывается с его влиянием на эндотелий и воспалительные процессы.
Связь ТМАО с сердечно-сосудистыми заболеваниями (ССЗ)³
Атерогенез и накопление холестерина: ТМАО стимулирует макрофаги к поглощению холестерина, увеличивая их превращение в пенистые клетки, которые способствуют образованию атеросклеротических бляшек. Этот процесс связывает ТМАО с метаболизмом липидов и транспортом холестерина⁴.
Регуляция синтеза холестерина и липопротеинов: ТМАО также влияет на экспрессию генов, регулирующих липидный обмен. Исследования показывают, что он активирует сигнальные пути, связанные с синтезом липопротеинов низкой плотности (ЛПНП), что приводит к увеличению их уровня в крови⁵.
Нарушенная регуляция сосудистого тонуса: ТМАО снижает продукцию оксида азота (NO), нарушая сосудорасширение и способствуя гипертензии.
ТМАО вызывает образование реактивных форм кислорода (РФК) в эндотелиальных клетках, что повышает окислительный стресс и нарушает функцию эндотелия. Он способствует активации молекул адгезии, что ускоряет атерогенез, воспаление и повреждение сосудов.
Редокс-гомеостаз и воспаление: ТМАО активирует⁶ провоспалительные сигнальные пути, такие как NF-κB, которые усиливают воспалительный ответ и способствуют повреждению клеток эндотелия.
ТМАО и диабет⁷
Исследования показывают, что высокие уровни ТМАО в плазме связаны с нарушением регуляции уровня глюкозы, инсулинорезистентностью и риском развития диабета 2 типа. Одно из них отразило, что повышенные уровни ТМАО связаны с ухудшением толерантности к глюкозе и увеличением уровня сахара в крови в течение двух лет наблюдения у пациентов без диабета на начальном этапе⁸.
Оно же продемонстрировало взаимосвязь появления осложнений диабета с высоким уровнем ТМАО. У пациентов с диабетом и микрососудистыми осложнениями (например, альбуминурией) повышенные уровни ТМАО связаны с прогрессирующим снижением функции почек и сосудистыми нарушениями. Это свидетельствует о роли ТМАО как предиктора ухудшения состояния у пациентов с диабетом.
Влияет инсулинорезистентность: Высокий уровень ТМАО усиливает окислительный стресс, что может нарушать чувствительность к инсулину.
Генетических мутациях FMO3 (например, при триметиламинурии).
Заболеваниях печени, влияющих на ферментативную функцию.
2. Микробиоту кишечника:
Повышенный ТМА может указывать на избыточную активность бактерий кишечника, метаболизирующих холин, карнитин, лецитин или бетаин, что наблюдается при некоторых нарушениях микробиоты.
3. Риск сердечно-сосудистых заболеваний:
Высокие уровни ТМАО, как и повышенное соотношение ТМАО/ТМА, связаны с развитием атеросклероза, сосудистого воспаления и других патологий.
В норме:
Триметиламин (ТМА): от 0,064 до 1,54 мкмоль/л. Повышение уровня может быть вызвано преобладанием в рационе питания продуктов животного происхождения — мяса, яиц, молока, а также наличием генетической патологии.
Концентрация ТМАО в крови человека у здоровых лиц остается спорным вопросом. По данным Bain et al она определяется на уровне 37,8±20,4 мкмоль/л (2110±1139 нг/мл), согласно исследованию Duranton et al нормальное значение ТМАО составило 38,81±20,37 мкмоль/л (2167±1139 нг/мл). Повышение характерно для перечня воспалительных заболеваний, о которых говорилось выше. Снижение наблюдается при проведении курса антибиотикотерапии.
Соотношение ТМА/ТМАО обычно остается низким, поскольку большая часть ТМА метаболизируется в печени.
Нарушения соотношения:
Высокое соотношение ТМА/ТМАО (много ТМА, мало ТМАО): характерно для триметиламинурии или дефицита FMO3.
Высокий уровень ТМАО при нормальном или низком уровне ТМА: связан с высоким риском сердечно-сосудистых заболеваний.
Для оценки метаболизма и риска рекомендуется сочетание анализа микробиоты, генетического тестирования на мутации FMO3 и измерения уровней ТМА и ТМАО в плазме крови.
На сегодняшний день мы имеем много инструментов для предупреждения частых заболеваний. Увеличение количества ТМАО, как и многих окисленных продуктов, является реакцией клеточного стресса и воспалением, что делает ТМАО фактором риска, особенно для сердечно-сосудистых заболеваний. ТМАО представляет собой биомаркер и потенциальную мишень для выявления ССЗ и метаболических нарушений. Необходимы дальнейшие исследования для разработки подходов к исследованию его уровня. Уже ведется разработка ингибиторов ТМАО, для возможности его снижения через ингибирование флавинсодержащих монооксигеназ в печени. Исследуют влияние диеты, пробиотиков и пребиотиков на снижение уровня ТМА/ТМАО. На данный момент можно оценить его в лаборатории Chromolab. Анализ проводится методом ВЭЖХ-МС в крови и моче. Таким способом количество данных метаболитов посчитается особо точно, обеспечив лучшие условия для диагностики степени повреждения сосудов и почек. Для точной интерпретации результатов анализа крови на триметиламин (ТМА), триметиламин-N-оксид (ТМАО) и их соотношение необходимо обратиться к врачу.
¹ Shanmugham, M.; Bellanger, S.; Leo, C.H. Gut-Derived Metabolite, Trimethylamine-N-oxide (TMAO) in Cardio-Metabolic Diseases: Detection, Mechanism, and Potential Therapeutics. Pharmaceuticals 2023, 16, 504. https://doi.org/10.3390/ph16040504
² Oliveira A, Faria A, Oliva M. Fish Malodour syndrome in a child. BMJ Case Rep. 2015 Apr 13; 2015:bcr2014207002. doi: 10.1136/bcr-2014-207002. PMID: 25870212; PMCID: PMC4401951.
³ REVIEW article, Front. Endocrinol., 07 February 2023, Sec. Cardiovascular Endocrinology, Volume 14 - 2023 | https://doi.org/10.3389/fendo.2023.1085041
⁴ REVIEW article, Front. Cardiovasc. Med., 13 June 2022, Sec. Atherosclerosis and Vascular Medicine, Volume 9 – 2022 | https://doi.org/10.3389/fcvm.2022.864600
⁵ Zhen Jing , Zhou Zhou , He Meng , Han Hai-Xiang , Lv En-Hui , Wen Peng-Bo , Liu Xin , Wang Yan-Ting , Cai Xun-Chao , Tian Jia-Qi , Zhang Meng-Ying , Xiao Lei , Kang Xing-Xing
The gut microbial metabolite trimethylamine N-oxide and cardiovascular diseases
Frontiers in Endocrinology VOLUME 14 YEAR 2023
https://www.frontiersin.org/journals/endocrinology/articles/10.3389/fendo.2023.1085041
⁶ Shanmugham, M.; Bellanger, S.; Leo, C.H. Gut-Derived Metabolite, Trimethylamine-N-oxide (TMAO) in Cardio-Metabolic Diseases: Detection, Mechanism, and Potential Therapeutics. Pharmaceuticals 2023, 16, 504. https://doi.org/10.3390/ph16040504
⁷ Diabetes is Associated with Higher Trimethylamine N-oxide Plasma Levels, M. Dambrova , G. Latkovskis , J. Kuka , I. Strele , I. Konrade , S. Grinberga , D. Hartmane , O Pugovics , A. Erglis , E. Liepinsh https://www.thieme-connect.com/products/ejournals/abstract/10.1055/s-0035-1569330
⁸ Plasma trimethylamine N-oxide and its metabolic precursors and risk of mortality, cardiovascular and renal disease in individuals with type 2-diabetes and albuminuria, Signe Abitz Winther ,Jens Christian Øllgaard,Tine Willum Hansen,Bernt Johan von Scholten,Henrik Reinhard,Tarunveer Singh Ahluwalia,Zeneng Wang,Peter Gæde,Hans-Henrik Parving,Stanley Hazen,Oluf Pedersen,Peter Rossing, Published: March 3, 2021 https://doi.org/10.1371/journal.pone.0244402
Запись на эту дату уже закрыта, пожалуйста выберите другую.