
Оксидативный стресс — это нарушение равновесия между образованием активных форм кислорода и азота и возможностями антиоксидантной системы компенсировать их эффект. Окислительный стресс приводит к повреждению липидов, белков и ДНК, снижает функциональный резерв тканей и усиливает воспалительные реакции. Этот механизм рассматривается как ключевая платформа прогрессирования множества хронических заболеваний.
Когда пациенты обращаются на прием с жалобами на постоянную усталость, «туман» в голове, снижение работоспособности и длительное восстановление после нагрузки, установить причины не сложно: стресс, воспаление, дефициты, нарушения сна, возрастные изменения, переутомление. Иногда - всё сразу. В таких ситуациях важно помнить: подобные проявления часто отражают фундаментальные нарушения в клеточном гомеостазе. Оксидативный стресс становится фоном, при котором любые негативные факторы оказывают более значимый эффект, а стандартные схемы лечения работают хуже. Комплексная оценка показателей, характеризующих выраженность окислительного дисбаланса, помогает врачу эффективнее управлять состоянием пациента.
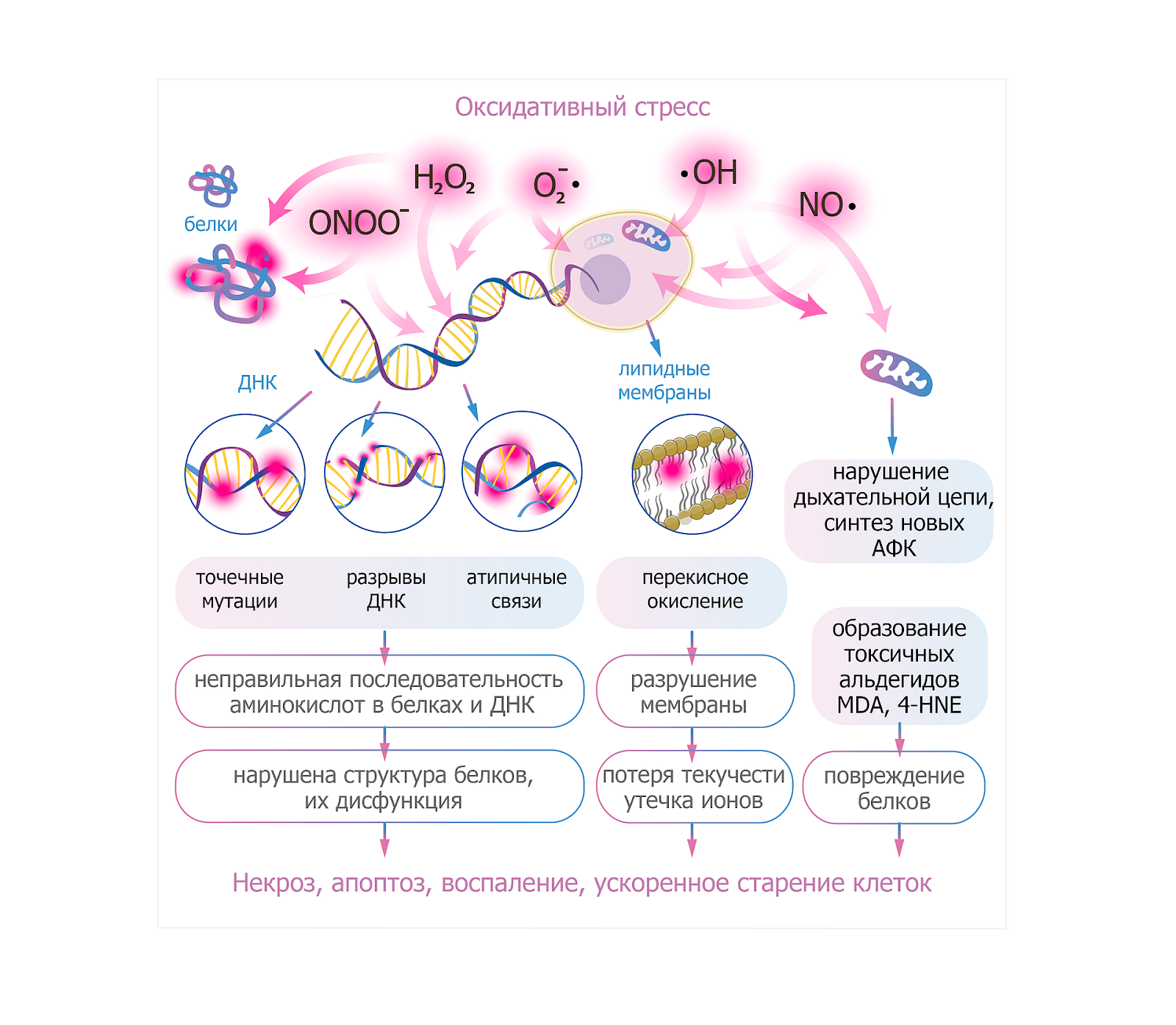
Свободные радикалы - это группа соединений, общей особенностью которых является их высокая реакционная способность. Молекулы свободных радикалов имеют неспаренные электроны и стремятся «добрать» недостающие, вступая в быстрые реакции с липидами, белками и нуклеиновыми кислотами. Наиболее изученные группы - активные формы кислорода и активные формы азота.
Активные формы кислорода (АФК) образуются преимущественно в митохондриях в процессе окислительного фосфорилирования. Это нормальный побочный продукт реакций дыхательной цепи, по итогу которых небольшая часть кислорода неизбежно превращается в супероксид. В цитозоле радикалы образуются под действием ферментов, таких как НАДФН-оксидаза, ксантиноксидаза и цитохром P450.
Активные формы азота (АФА) - преимущественно оксид азота (NO) и пероксинитрит, которые образуются при работе NO-синтаз и при взаимодействии NO с АФК. NO крайне важен для регуляции сосудистого тонуса, миграции иммунных клеток, нейрональной сигнализации. В условиях повышенной оксидативной нагрузки NO связывается с АФК, образуя соединения, способные инициировать окислительные повреждения.
В низких физиологических концентрациях АФК и АФА - ключевые регуляторы клеточных процессов:
- Иммунный ответ. Фагоциты используют «оксидативный взрыв» (резкое повышение продукции АФК) для уничтожения патогенов. АФК также участвуют в активации иммунных сигнальных путей.
- Сосудистая регуляция. NO способствует вазодилатации, участвует в управлении микроциркуляцией и гемодинамической адаптацией. Дисбаланс АФК нарушает биодоступность NO.
- Клеточный сигналинг. При низких концентрациях радикалы участвуют в работе редокс-зависимых транскрипционных факторов (NF-κB, Nrf2), модулируют экспрессию генов, отвечающих за адаптацию, антиоксидантную защиту и метаболизм.
- Апоптоз и обновление тканей. АФК необходимы для запуска программ удаления повреждённых клеток и поддержания тканевого гомеостаза.
- Адаптация к нагрузкам. Умеренное повышение АФК при физической активности стимулирует митохондриальный биогенез и усиливает стрессоустойчивость.
Продукция АФК и АФА резко увеличивается на фоне воспаления, гипоксии, интенсивных физических нагрузок, под действием ультрафиолетового излучения, табачного дыма, ксенобиотиков, избыточного поступления железа и других неблагоприятных факторов. Свободные радикалы обладают высокой химической активностью и взаимодействуют с теми структурами клетки, которые наиболее уязвимы к окислению. Повреждение развивается не одномоментно: сначала страдают наиболее реакционноспособные молекулы, затем — структуры, обеспечивающие целостность клетки и её метаболизм.
Липиды мембран: нарушение структуры и проницаемости. Клеточные мембраны - первая линия повреждения. Ненасыщенные жирные кислоты мембран легко вступают в реакции перекисного окисления. Это запускает цепную реакцию, в ходе которой образуются токсичные продукты: малоновый диальдегид, 4-гидроксиноненаль и другие. В результате изменяется текучесть мембран, нарушается функция рецепторов и мембранных ферментов, ухудшается транспорт ионов и питательных веществ, падает устойчивость клетки к внешним факторам. Это приводит к снижению способности тканей адекватно реагировать на сигналы и поддерживать гомеостаз.
Белки и ферменты: падение активности и структурная деформация. Окисление аминокислот приводит к изменению третичной и четвертичной структуры белков. Особенно уязвимы ферменты, транспортные белки, рецепторы и гормональные медиаторы. Белковые повреждения участвуют в механизмах развития инсулинорезистентности, нейродегенеративных процессов и хронического воспаления.
Нуклеиновые кислоты: мутации, нарушения репарации и клеточная нестабильность. ДНК и РНК — мишени, особенно уязвимые для воздействия радикалов. При окислении азотистых оснований образуется группа соединений, которые объединяют под общим названием «продукты окислительного повреждения нуклеиновых кислот», к числу которых относятся 8-гидроксидезоксигуанозин (8-OHdG), 8-гидроксигуанозин (8-OHG) и 8-гидроксигуанин (8-OHGua). Последствия повреждения - ошибки репликации и транскрипции, активация систем репарации, остановка клеточного цикла. Накопление подобных ошибок приводит к повышению риска мутаций и канцерогенезу. Клетки с высоким темпом деления (эпителий, клетки иммунной системы) реагируют особенно остро.
Митохондрии: снижение энергетической эффективности. Митохондрии одновременно являются и продуцентом АФК, и их мишенью. Радикалы повреждают ферменты дыхательной цепи и мембраны митохондрий, нарушая транспорт электронов. Это приводит к снижению скорости образования АТФ, переходу на менее эффективные пути энергообеспечения, что, в свою очередь, усиливает образование АФК и запускает механизмы апоптоза при критическом повреждении.
Внеклеточный матрикс: нарушение регенерации тканей. Окислительные процессы воздействуют на коллагеновые и эластиновые структуры. Это вызывает снижение эластичности сосудов, ускорение фиброзирования тканей, нарушение процессов заживления и регенерации.
Иммунная система: сбой регуляции и хроническое воспаление. Реактивные молекулы активируют фактор транскрипции NF-κB и другие провоспалительные каскады. Это приводит к повышению продукции цитокинов, устойчивому системному воспалению низкой интенсивности, усилению повреждения тканей и самоподдержанию порочного круга оксидативного стресса.
Повреждающему действию оксидативного стресса противостоит многоуровневая система защиты, включающая ферментативные и неферментативные антиоксиданты, механизмы регенерации и репарации. Её состояние определяет, насколько успешно организм удерживает редокс-баланс.
Глутатионовая система: главный внутриклеточный буфер (GSH)
Глутатион (GSH) — ведущий низкомолекулярный антиоксидант, которому принадлежит ключевая роль в нейтрализации реактивных форм кислорода азота. Глутатион осуществляет нейтрализацию перекисей и восстановление окисленных соединений, поддерживает структуры митохондрий, участвует в работе ферментов II фазы детоксикации. При снижении уровня глутатиона в митохондриях снижается выработка энергии, усиливается образование АФК, и формируется порочный круг оксидативного повреждения. Лабораторное исследование концентрации глутатиона отражает функциональный резерв клетки: низкий уровень GSH свидетельствует об истощении антиоксидантных ресурсов.
Антиоксидантная защита липидных мембран.
Витамин E (α-токоферол) прерывает цепные реакции перекисного окисления, стабилизирует мембраны и предотвращает повреждение их структуры. Достаточный уровень витамина Е особенно важен для состояния нервной ткани, эндотелия сосудов, гепатоцитов, тканей репродуктивной системы. Низкий уровень α-токоферола - индикатор уязвимости мембран к перекисному окислению липидов..
Коэнзим Q10 (убихинон) осуществляет перенос электронов в дыхательной цепи митохондрий и участвует в выработке энергии. CoQ10 способен восстанавливаться собственными ферментными системами организма, поэтому его антиоксидантный потенциал поддерживается даже при высокой нагрузке. Кроме того, CoQ10 регенерирует α-токоферол, возвращая витамину Е его активную форму. По силе антиоксидантного действия CoQ10 превосходит α-токоферол. Коэнзим Q10 - один из лабораторных маркеров, которые помогают оценить способность митохондрий выдерживать метаболическую нагрузку.
Каротиноиды и витамин A: стабилизация мембран и иммунный контроль
Бета-каротин и витамин А (ретинол) функционируют как “ловушки” радикалов в липидной среде. Благодаря наличию двух сопряженных двойных связей ретиноиды эффективно нейтрализуют высокоактивные формы кислорода, которые в большом количестве образуются под воздействием ультрафиолета. Кроме того, витамин A (ретинол) выполняет иммуномодулирующие функции - поддерживает тканевые барьеры и регулирует интенсивность воспалительных реакций.
Основной водорастворимый антиоксидант: витамин C.
Витамин C сосредоточен в гидрофильном пространстве вне- и внутри клеток, и осуществляет нейтрализацию водорастворимых свободных радикалов. Аскорбиновая кислота обладает способностью восстанавливать α-токоферол после контакта с радикалами. Таким образом, витамин C является связующим элементом антиоксидантной защиты между гидрофильной и липофильной фазами и маркером системной способности плазмы противостоять окислительному стрессу.
Маркеры оксидативного повреждения:
Малоновый диальдегид (МДА) не участвует в нейтрализации радикалов. МДА образуется как итоговый продукт перекисного окисления липидов и рассматривается как один из наиболее надежных показателей окислительного повреждения клеток. Уровень малонового диальдегида позволяет оценить:
- интенсивность перекисного окисления липидов;
- выраженность повреждения липидов клеточных мембран;
- эффективность работы антиоксидантных систем (опосредованно).
Гуанозины и их производные, такие как 8-гидроксидезоксигуанозин (8-OHdG), 8-гидроксигуанозин (8-OHG) и 8-гидроксигуанин (8-OHGua), являются маркерами оксидативного повреждения нуклеиновых кислот. Среди природных азотистых оснований гуанин обладает самым низким потенциалом ионизации, поэтому наиболее подвержен окислительному повреждению.
Значение оксидативного стресса в клинической практике.
Кардиология: снижение доступности NO приводит к нарушению механизмов вазодилатации и повышению агрегации тромбоцитов. На этом фоне ускоряется окисление липопротеинов низкой плотности, увеличивается нестабильность атеросклеротических повреждений, повышается риск тромбоза и других осложнений.
Эндокринология: гипергликемия и инсулинорезистентность - состояния, способствующие избыточной продукции оксидантов. Это, в свою очередь, усугубляет резистентность тканей к инсулину, нарушает функцию митохондрий, вносит вклад в прогрессирование стеатоза печени.
Неврология: высокая липофильность тканей мозга и интенсивное потребление кислорода делают его крайне уязвимым к окислительному повреждению. Оксидативный стресс участвует в патогенезе когнитивных нарушений, депрессии, нейровоспаления, деменции.
Гастроэнтерология: оксидативный стресс усиливает воспаление в слизистой ЖКТ, нарушает барьерную функцию, поддерживает течение хронического гастрита, панкреатита, ВЗК. Дисбиоз тоже вносит вклад: микробиота активно участвует в регуляции редокс-статуса.
Врачи общей практики и терапевты: пациенты с неспецифичными жалобами на усталость, слабость, сниженную переносимость нагрузок, непостоянные боли, «туман» в головет часто имеют скрытые нарушения редокс-баланса. Лабораторные маркеры позволяют оценить выраженность нарушений и сформировать индивидуальную стратегию их коррекции.
Исследования в лаборатории CHROMOLAB:
MOS-14 Оксидативный стресс (7 показателей), метод ХМС
MOS-03 Глутатион свободный в крови
MOS-02 Коэнзим Q10 в крови
MOS-04.1 Малоновый диальдегид (стабильный конечный продукт ПОЛ) в крови
V11.1 Витамин E (альфа-токоферол), метод ХМС
V07.1 Витамин А (ретинол), метод ХМС
V08.1 Бета-каротин (транс-форма) в крови
V12.1 Витамин C (аскорбиновая кислота) в крови
MOS-16 Гуанозины: маркеры оксидативного повреждения нуклеиновых кислот в моче
Запись на эту дату уже закрыта, пожалуйста выберите другую.